【第1部】肺がん治療の3つの革命と残された課題:臨床現場から見たアンメットニーズと創薬アイディア

ポッドキャスト(英語)で聞く
先日、とある大手製薬企業から講演の依頼をいただきました。
「臨床医の目線から、我々製薬企業にどんなことを期待しているのか。」
「臨床現場で感じるアンメットニーズ(満たされていない医療ニーズ)について話してほしい。」
そんなリクエストをいただき、講演をさせていただきました。
私は呼吸器内科医として約10年間、数えきれないほどの肺がん患者さんと向き合ってきました。そして現在は、アメリカで肺がんの基礎研究に関わっています。
今回は、臨床現場を知る基礎研究者として、私が考える医薬品開発の課題と可能性について、製薬会社の皆さんにお話しした内容をお届けしたいと思います。
また、この講演の後半では、産学連携の重要性についても私なりの考えを共有いたしました。そちらの内容にご興味がある方は、第2部も一読ください。
なお、これらの記事は筆者の診療経験と研究活動に基づく個人的な見解であることをご了承ください。また、医療に関わる情報も初稿時の2025年6月時点でのものであることをご理解ください。
医療の限界と希望 – 肺がん診療の最前線から
私たち呼吸器内科医は、最も多くの看取りを経験する診療科の1つです。そのため、これまでに数多くのアンメットニーズを実感してきました。
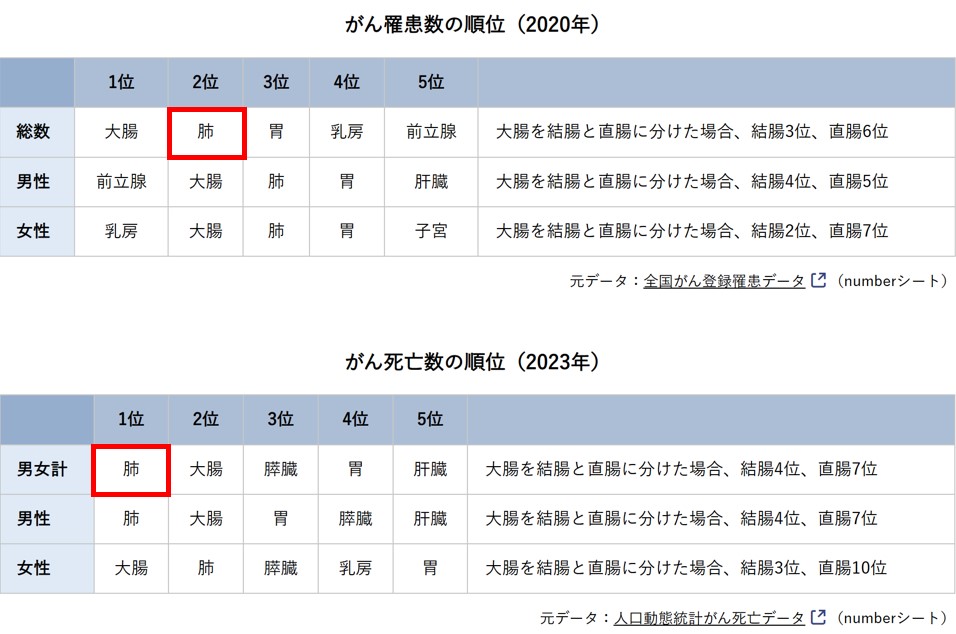
その中でも肺がんは、日本で新たに診断される患者数が年間約12.6万人と全がん種で第2位(2020年データ*)、がんによる死亡数では年間約7.6万人で第1位を占めています(2023年データ*)。この数字からも、肺がんが最も深刻な疾患の一つであることがわかります。
今回は、この肺がんに焦点を絞り、医療現場で感じる課題と希望について、様々なトピックを取り上げながらお話ししていきます。
*全国がん登録罹患データ
https://ganjoho.jp/reg_stat/statistics/data/dl/index.html*人口動態統計がん死亡データ
https://ganjoho.jp/reg_stat/statistics/data/dl/index.html#a7
医療の限界 – 忘れられない患者さんたちとの思い出
現在、日本では2人に1人ががんになる時代と言われており、死亡原因の1位は悪性新生物(がん)です。呼吸器内科医が扱う肺がんは、進行期であるステージ4が最も多く、つまり遠隔転移がある状態で発見されることが少なくありません。この場合、現在の医療では根治がなかなか難しく、患者さんの健やかな時間をいかに延ばすかが最大の治療目標になります。
以下に、私が医療の限界を痛感したエピソードをお示しします。ここでは、本人の特定を避けるためにフィクションを交えつつ、詳しい病状も省いています。
30歳の女性 – EML4-ALK融合遺伝子陽性肺腺がん
私は毎日朝と夕方に回診をしていました。そして、夕回診の際にはいつも本人がいないところで、患者さんの待合室でお母様に呼び止められました。
「先生、私は娘の結婚は諦めました。でも、どうか1日だけでも彼女を長く生きさせてください。」
毎日毎日、同じ言葉を繰り返すお母様。その手は震え、目には涙が溢れていました。私は何と答えればよいのか分からず、ただ「全力を尽くします」としか言えませんでした。
30歳の男性 – EGFR遺伝子変異陽性肺腺がん
この方は治験に参加していただいていたこともあり、深い付き合いがありました。脳転移の病変が大きく、脳浮腫を抑えるために大量のステロイドを使用していました。しかし、ステロイドの副作用の1つである手足のしびれが、彼を苦しめていました。そして、ある日、限界に達した彼は私にこう言いました。
「先生、もう耐えられません。寝かせてください。」
日本では安楽死は認められていませんが、耐えられない苦痛を伴っている場合は鎮静剤を使って眠っていただくことが可能です。本人と家族と相談の上、鎮静を開始することになりました。意識が薄れていく中、彼が最後にこのような言葉を私に託しました。
「どうか、研究で肺がんを治せる病気にしてください」
この言葉は、今でも私の研究の原動力になっています。
希望の光 – 3つの革命的な研究成果
しかし、暗い話ばかりではありません。基礎研究がもたらした感動的な経験も数多くありました。ここでは、私が体験した医療の発展に大きく寄与した3つの革命をご紹介します。
革命 1:分子標的薬(キナーゼ阻害薬)の登場
現在、肺腺がんでは8種類*の遺伝子異常が特異的に治療可能になっています。これにより、アジア人の肺腺がんの約60%をカバーできるようになりました。私の経験上、従来の点滴による抗がん剤治療に比べて、分子標的薬(キナーゼ阻害薬)は副作用が少なく、奏効率も高い印象があります。
*2025/11/16追記:最近、参加した学会で10種類に増えていたことを知りました。最近の医療の発展はめまぐるしく追いついていくが本当に大変です。
劇的な変化を目の当たりにした症例
40歳の女性、EGFR遺伝子変異陽性の肺腺がんの患者さん。第1世代EGFR阻害薬のゲフィチニブ(イレッサ)を投与したところ、劇的に原発巣と遠隔転移病変の縮小を認めました。
入院時はほぼ寝たきりだった方が、わずか1ヶ月の治療で歩いて退院される。その姿を見た時、「これが基礎研究の力か」と全身に鳥肌が立ちました。
また、CTを撮影した放射線科医の方から電話がかかってきたことも覚えています。
「先生、こんなに短期間で肺がんが縮小するなんて…。何か新しい薬でも出たんですか?」
それほど劇的な効果でした。
さらなる進化 – 耐性を克服する第3世代薬
EGFR阻害薬は平均すると約1年で耐性化します。その耐性化機序の約半分は、ATP Binding Pocket 領域の二次変異であるT790M変異が原因でした。その、二次変異にも奏功するEGFR阻害薬が既に10年以上前に開発されました。
ここでは、75歳の男性患者さんの例をご紹介します。EGFR遺伝子変異陽性で第1世代のゲフィチニブを使用していましたが、耐性化して多発肺内転移を認めました。CTガイド下肺生検でRe-biopsyを行い、T790M変異が陽性と判明。第3世代EGFR阻害薬のオシメルチニブを投与したところ、多発肺内転移は劇的に縮小しました。
「先生、また息が楽になりました。孫の顔を見に行けます」
そう言って笑顔を見せてくれた患者さんの表情は、今でも忘れられません。
革命 2:免疫チェックポイント阻害薬の登場
2015年、私が内科レジデントの時のことです。市中病院で働いていたある日、呼吸器内科部長から突然呼び出されました。
「何かすごい薬が出たぞ」
そう言って渡された論文。それがニボルマブ(オプジーボ)の臨床試験結果でした。がん細胞が免疫細胞にかけている「ブレーキ」を外すことで、患者さん自身の免疫力でがんを攻撃するという従来の抗がん剤や分子標的薬とは全く異なる仕組みの薬剤でした。これは臨床現場にとって、衝撃的な出来事でした。
実際に、効果が得られる患者さんでは長期間にわたって効果が持続するケースも多く、従来の治療では得られなかった治療成績を示していました。しかし、課題もあります。現在のところ、効果予測マーカーはPD-L1発現のみとされていますが、実際にはPD-L1が高発現でも効かない患者さんもいれば、逆に低発現でも著効する患者さんもいます。したがって、より精度の高いバイオマーカーが見つかれば、EGFR阻害薬のように、さらに進化するように感じます。
革命 3:KRAS阻害薬の登場
KRAS変異は、全がん種で最も頻度の高い遺伝子異常の一つです。特に肺がんでは約30%の患者さんがKRAS変異を持っています。ところが、この遺伝子産物であるKRASタンパク質は、従来の創薬技術では標的にできない構造をしていました。
具体的には、KRASタンパク質の表面は平坦で、薬剤が結合できる「ポケット」がほとんどありません。そのため、長年「Undruggable(薬にできない)」と言われ続けてきました。結果として、KRAS変異陽性の患者さんは、全身化学療法以外に有効な治療選択肢が限られていたのです。
しかしながら、ついにこのNo Man’s Landが克服されつつあります。研究者たちは、KRASタンパク質が活性型と不活性型を行き来することに着目しました。そして、不活性型の時にだけ現れる隠れた結合部位(クリプティックポケット)を発見したのです。この発見により、従来は「平坦で薬が結合できない」とされていたKRASタンパク質に、薬剤が結合できるようになりました。
私が留学中に承認されたこれらの薬剤について、臨床の同僚たちは「効果はまだまだだけど、これから良くなるはず」と期待を寄せています。実際、現在も多くの製薬会社がより効果的なKRAS阻害薬の開発競争を繰り広げており、さらにG12C以外の変異(G12DやG12Vなど)を標的とした薬剤も臨床試験段階にあります。
このように、「不可能」とされていた領域での突破口が開かれたことで、がん治療の新たな時代が始まったと言えるでしょう。
それでも残る課題 – 現場で感じるアンメットニーズ
これまで医療の革命的な進歩についてお話ししてきましたが、実際の診療現場では、まだまだ多くの課題が残されています。日々の診療を通じて感じる「満たされていない医療ニーズ」について、診断から治療まで、具体的にご紹介していきます。
診断と治療の一般的なフロー
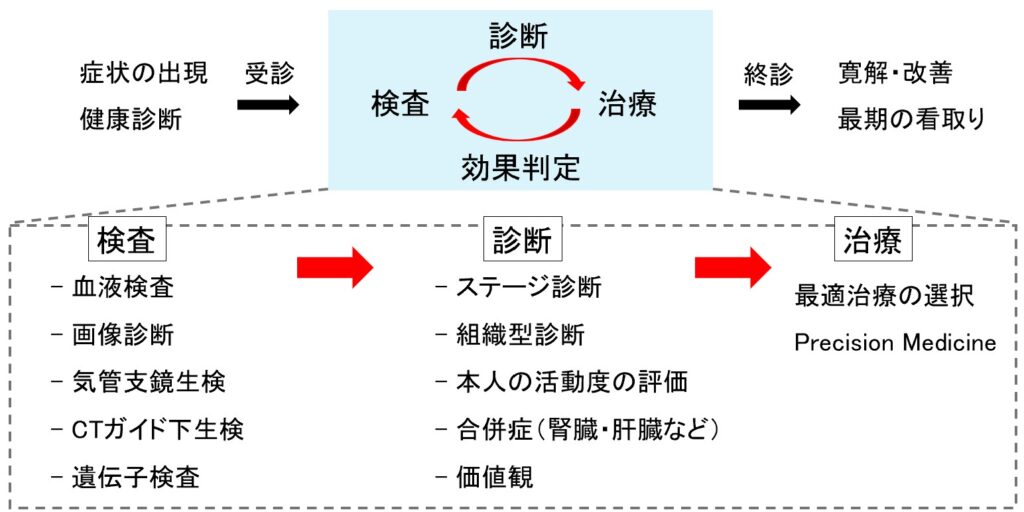 まず、肺がんの診断から治療開始までの一般的な流れを整理してみましょう。患者さんは症状の出現や健康診断の異常で受診され、私たちは段階的に以下の検査を行います。
まず、肺がんの診断から治療開始までの一般的な流れを整理してみましょう。患者さんは症状の出現や健康診断の異常で受診され、私たちは段階的に以下の検査を行います。
血液検査から始まり、画像検査(レントゲン、CT、MRI、PET)、そして確定診断のための気管支鏡肺生検やCTガイド下肺生検を実施します(もしくは、転移部位の生検)。最後に、分子標的薬の適応の有無を判断するために遺伝子検査を行います。
これら一連の検査には約1ヶ月を要します。その後、ステージ診断と組織型診断を確定し、患者さんの全身状態、合併症の有無、そしてご本人の価値観なども考慮して、最適な治療を選択していきます。
そして、治療開始後2クール(約2ヶ月)を目安に効果判定を行います。各種検査を再度実施し、その結果をみて治療継続か変更かを判断します。
このように実際の臨床では、診断と治療の繰り返しサイクルが治療の核となります。私は、この検査→診断→治療→効果判定の部分(上図の青枠)が、特に、基礎研究の成果を臨床に活かせる領域だと考えています。
では、次のセクションから各フェーズの課題とそれを克服するようなアイディアについて一緒に見ていきましょう。
検査における課題とアイデア
血液検査 – 手軽だが可能性は無限大
血液検査の最大の利点は、患者さんへの負担が少なく、毎日でも実施できることです。現在、私が最も期待しているのが、治療効果を予測できるバイオマーカーの開発です。「どの患者さんにどの治療が効くか」を事前に予測できれば、無駄な治療や副作用のリスクを大幅に減らせます。また、治療中も定期的な血液検査で効果判定や耐性化の早期発見が可能になります。
現在、この理想に最も近い技術が、血液中に流れる腫瘍由来のDNA断片を検出するリキッドバイオプシー(液体生検)です。効果予測・判定ともに有用性が示されていますが、現時点において、日本では生涯に一度しか保険適用されていません。コスト問題が解決されれば、治療のモニタリングツールとして革命的な変化をもたらすはずです。
*ここ数年リキッドバイオプシーの発展は凄まじく、非常に高い感度・特異度のアッセイが開発されてきています。ご興味がある方はMRD (molecular residual disease)について調べてみると面白いと思います。
将来的には、DNAだけでなくRNAやタンパク質などの網羅的解析も、より簡便に実施できるようになるかもしれません。これらの解析結果が新たなバイオマーカーとして治療選択や効果予測に活用されれば、より精密な個別化医療が実現できるはずです。
ただし、こうした高度な解析にはサンプルの量や質の問題がつきものです。患者さんの腫瘍細胞を培養して増やすオルガノイド技術なども、この分野の発展を加速させるのではないでしょうか。また、この頃にはデータ量も膨大になるので、解析にはAIを併用していくことになると思います。
画像診断 – AIと新技術への期待
画像診断における最大の課題は、鑑別診断の難しさです。プロの放射線科医でも判断に迷うケースが少なくありません。実際、私も健康診断の胸部CT画像の読影を数年間していましたが、「これはがんなのか、それとも炎症なのか」と判断に迷う時が数多くありました。似たような画像所見でも、実際の病理結果は全く異なることが多々あります。
しかし、ここでもAI技術が解決策となります。膨大な画像データから人間では見つけられない微細なパターンを発見し、診断精度の向上が期待できます。
現在、画像診断のAI開発は非常に多くの企業が行っていますが、人口当たりのCT台数は世界の中で日本が圧倒的に多く、臨床情報との紐づけもきちんとされているように思います。こういった高品質のデータに、民間企業がアクセスできるようにする仕組み作りが大事だと思います。
その他、画像診断と特殊な試薬を組み合わせて腫瘍の性質をより詳しく調べるための技術も開発されてきています。
具体的には、専用の試薬を静脈内に注入し、数秒から数十秒後にCT撮影を実施します。そして、試薬が腫瘍にどの程度取り込まれるかを観察することで、その腫瘍の特性を詳しく分析します。
これまでのCT検査では、血管や臓器を鮮明に写すヨード造影剤が主流でした。しかし将来的には、腫瘍の生物学的特性を調べるために、様々な造影剤が登場してくるように思います。特に、代謝の仕方に異常をきたす癌種はいい適応になるかもしれません。
こうした技術の進歩により、画像診断は単に「腫瘍の形を見る」検査から、「腫瘍の性質を深く知る」検査へと進化していくように考えます。
気管支鏡肺生検 – 3D技術とAIの融合
気管支鏡検査では、病変の位置によっては生検が極めて困難な場合があります。せっかく入院していただいたにも関わらず、十分な組織が採取できないケースも存在します。さらに、長時間の検査は出血や感染症のリスクを高めるという問題もあります。
この課題に対する解決策として、CT画像から患者さんごとの気管支構造を3Dモデル化し、AIによって最適な生検経路を提案する技術が開発されてきています。
遺伝子検査 – 限られたサンプルとの闘い
現在の肺がん診療では、組織型の確認、遺伝子変異の検索、PD-L1発現の測定など、確認すべき項目が大幅に増えています。それに伴い、必要なサンプル量も増加し続けているのが現状です。
サンプルが不足した場合、「EGFR変異だけ調べて、他の検査は断念する」といった厳しい選択を迫られることもあります。この課題を解決するには、AIを活用した病理診断による必要サンプル数の削減や、少量サンプルでも実施可能な網羅的遺伝子パネル検査の開発が重要だと思います。また、オルガノイドで癌細胞を増やしてから検査を行うという手法も有望な選択肢かもしれません。
治療における深刻な課題
併存疾患への対応 – 使える薬剤が限定的
抗がん剤の多くは腎臓や肝臓に大きな負担をかけます。そのため、重度の腎不全や肝不全を患っている患者さんには適宜用量調整をするものの、使用できる薬剤が限られてしまいます。
また、間質性肺炎という肺の病気を併発している患者さんのケースも深刻です。間質性肺炎では肺の組織に炎症が起こり、進行すると硬くなってしまいます。抗がん剤によってこの炎症がさらに悪化する危険性があるため、使用できる治療選択肢が極めて限定的であり、治療が非常に困難です。
さらに複雑なのは、このような併存疾患をお持ちの患者さんでは、併存疾患そのものが生存期間やQOLを左右する重要な要因となるため、がんの治療を安全に行える条件の範囲が狭くなり、場合によっては抗がん剤治療が困難と判断されることもあります。
このような患者さんでも安全に使用できる治療選択肢の開発は、現場で強く求められているアンメットニーズの1つだと思います。
脳転移 – 働く時代のがん治療への挑戦
今後、がん患者さんも働き続ける時代が到来すると思います。しかし、脳転移が発生すると、患者さんの日常活動度は一気に低下するリスクがあります。
解決すべき課題として、血液脳関門(BBB)を効率的に通過する薬剤の開発、BBB透過性を高める補助薬の開発、そして髄膜播種に特化した治療薬の開発が挙げられます。
薬剤耐性化 – 避けられない宿命
どんなに優れた抗がん剤も、やがては耐性化という壁にぶつかります。そのため、既存薬とは全く異なる作用機序を持つ薬剤の継続的な開発が不可欠です。
これまでに使われてきた分子標的薬は目的としたタンパク質のcatalytic activity(触媒活性)をキナーゼ阻害剤等で抑えることに焦点を当ててきました。しかし、近年では様々なタンパク質がcatalytic activity以外にもscaffold(足場)として、重要な機能を果たすことが分かってきました。さらには、そのタンパク質の細胞内局在も大切であることが判明してきています。
そのため、既にタンパク質を直接分解するPROTAC技術などが登場していますが、今後はそれ以外にも、タンパク質間の相互作用を抑える薬剤やタンパク質の局在を変えるような薬剤開発が面白いのではないでしょうか。こういった、既存の薬剤とは作用原理(mechanism of action)が異なる薬剤は、その効果次第では将来的にファーストライン(初回治療)に併用療法として組み込まれる可能性を秘めています。
副作用対策 – 患者さんのQOLを守るために
前半でも述べたように、Stage 4の固形癌では一般的に根治が難しいため、「いかに質の高い時間を過ごしていただくか」が治療方針の軸となります。生存期間を延ばしても、副作用で苦しい時間が増えてしまっては治療の目的から外れてしまいます。だからこそ、抗がん剤治療では常に効果と副作用のバランスを慎重に見極める必要があります。
ここでは、患者さんの生活に大きく影響しうる主な副作用について取り上げます。
脱毛
脱毛は、女性患者さんのQOLを最も深刻に低下させる副作用の一つです。「髪が抜けるなら治療を受けたくない」という切実な声を、これまで何度も聞いてきました。現在、保険適用される脱毛予防薬は私の知る限り存在せず、この分野での薬剤開発が期待されます。
血球減少 – 命に関わる感染症リスク
抗がん剤に伴う血球減少に対して、G-CSF製剤による治療がありますが、それでも重篤な感染症から敗血症を発症し、命を落とす患者さんがいるのが現実です。特に血液がんでは強力な抗がん剤を複数組み合わせて使用するため、より効果的な支持療法薬の開発が求められているように感じます。
ステロイド – 魔法の薬の光と影
ステロイドは、がん治療のみならず様々な診療科で使われる「魔法の薬」です。しかし、その一方で多岐にわたる副作用も抱えています。
現在は個々の副作用に対して予防薬を投与する対症療法的なアプローチですが、根本的なメカニズムを解明し、ピンポイントで副作用を抑制する薬剤が開発されれば、多くの患者さんが救われるはずです。
実際に、ステロイドの良い効果は保ちながら副作用を減らすことを目標とした選択的グルココルチコイド受容体調節薬(SGRM)と呼ばれる新しいタイプの薬剤の研究も進んでいるようです。
がん治療を脅かすもう一つの敵
抗生剤耐性 – 忍び寄る脅威
がん治療から少し視点を変えますが、抗生剤の薬剤耐性も無視できない深刻な問題です。院内感染により入院が長期化し、せっかくがん治療が順調に進んでいたにも関わらず、耐性菌感染によって命を落とす患者さんも存在します。
社会的背景を考慮した新たなニーズ
Society 5.0と未来の医療
政府が推進する「Society 5.0」構想では、医療分野においてリアルタイムの健康診断による早期発見、ロボットによる医療・介護現場での支援、そして医療費や介護費などの社会コスト全体の削減を目標として掲げています。超高齢化社会を迎える日本では、これらの実現が急務となっています。
内閣府 Cabinet Office, Society 5.0 新たな価値の事例(医療・介護), URL: https://www8.cao.go.jp/cstp/society5_0/medical.html, 閲覧日: 2025/06/09
早期診断と予防医療の重要性
早期診断による医療費削減
血液検査による微量ながん細胞の検出や、AIを活用した画像診断の精度向上により、重大な疾患の早期発見が可能になれば、医療費の大幅な削減につながります。現在の高度化した医療では、進行がんの治療費は年間数百万円に及ぶケースも多く、早期発見の経済的インパクトは計り知れません。
健康寿命延伸への取り組み
超高齢化社会を迎える日本において、アンチエイジング分野の重要性が高まっています。細胞老化の制御や代謝改善による疾患予防は、個人のQOL向上と社会保障費削減の両面において、意義深いように感じます。
精密医療による効率化
個人的な見解ですが、以下のような技術開発によって医療の費用対効果が向上するように思います。
- 治療効果を予測するバイオマーカー探索
- 薬剤の相互作用を予測するシステムの開発
- 個別化された薬剤の投与設計(薬物動態の個人差を考慮した最適な用法・用量の決定)
これらの技術により、無効な治療の回避と副作用の予防が実現し、患者さんの負担軽減と医療資源の効率的な運用ができると考えます。
尊厳のある最期を迎えるために
現在の医療現場では、90歳を超えた患者さんに家族の強い希望で人工呼吸器を装着するケースや、亡くなる前日まで抗がん剤治療を継続するケースも見受けられます。年齢や病状は患者さんそれぞれ異なり、健康状態や人生に対する価値観も多様ですが、過度な治療が時として患者さんの苦痛を増大させてしまうことも少なくありません。
「治療をやめる=諦める」という固定観念から脱却し、患者さんご本人の意思を尊重した選択ができるシステム作りが求められているように感じます。医療技術の進歩と併せて、このような意思決定を支援する体制の整備も重要だと思います。
がん患者さんが働き続けるために
前述のように、医療の進歩とともに、がん患者さんも治療を受けながら働き続ける時代が到来しています。しかし、がんに伴う様々な症状は、患者さんの就労継続を困難にする大きな要因となっています。こうした課題を解決することは、患者さんのQOL向上だけでなく、社会全体にとっても重要な意味を持ちます。
骨転移による疼痛 – 活動を制限する大きな壁
骨転移による痛みは、患者さんの活動を著しく制限します。現在は放射線治療と医療用麻薬による対症療法である程度の管理は可能ですが、さらに異なる作用機序を持つ効果的な疼痛管理薬があれば、患者さんのQOL向上に大きく貢献するでしょう。
悪液質 – 見過ごされがちな問題
固形がんは様々なサイトカインを分泌し、嘔気・嘔吐・食欲不振を引き起こします。その結果、患者さんは急激に痩せ細り、日常活動度が著しく低下してしまいます。
近年、悪液質の治療薬が承認され臨床現場で使用されるようになりました。私自身はまだ使用経験がないため効果について評価はできませんが、様々な作用機序を持つ薬剤が開発されることで、働くがん患者さんにとってより良い治療選択肢が提供されることを期待しています。
まとめ
臨床医として約10年、基礎研究者として約10年、これらの経験を重ね合わせながら、私は多くのことを学びました。分子標的薬や免疫チェックポイント阻害薬の登場により、肺がん治療は確実に進歩しています。しかし、それでもなお、多くの課題が残されているのが現実です。
次回の第2部では、その解決策の一つとして注目される「産学連携」について、私なりの考えをお話しします。なぜ今、大学と企業の協力が必要なのか。日本の創薬力低下という課題にどう向き合うべきか、現場で感じていることを共有させていただければ幸いです。

この記事は講演内容をもとに、医療現場での経験と研究活動を通じて得た知見をまとめたものです。医療に関する判断は必ず医師にご相談ください。